Was ist individualisierte Medizin?
In der Medizin bleibt die Entwicklung und Anwendung von Therapien mit maximaler Wirksamkeit und minimalen Nebenwirkungen eine fundamentale Herausforderung. Tatsächlich weisen zugelassene Therapien und Medikamente oftmals nur bei einem geringen Teil der Patienten gute Wirksamkeit auf, während andere Patienten keine Besserung erfahren oder sogar schwere und zum Teil gefährliche Nebenwirkungen entwickeln. Seit einigen Jahren sorgt in diesem Zusammenhang das Schlagwort Individualisierte Medizin (oft auch Personalisierte Medizin oder Präzisionsmedizin genannt) für lebhafte Diskussionen in Forschung, Klinik, Industrie und Gesundheitspolitik.
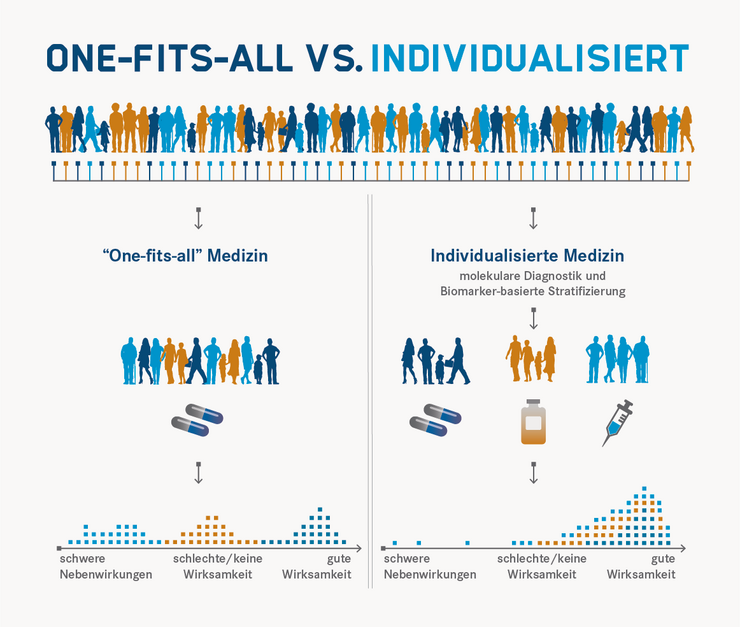
Bei der Individualisierten Medizin gehen der Behandlung diagnostische Tests voraus, deren Ergebnis eine auf Patient und Krankheitsbild passgenau abgestimmte Therapie oder auch Prävention ermöglichen soll. Dadurch werden nicht nur Wirksamkeit und Sicherheit für den einzelnen Patienten erhöht, sondern auch unnötige Kosten vermieden.
Wir wollen jeden Patienten bestmöglich behandeln.
Dieser Grundgedanke ist nicht ganz neu. Seit jeher ist die Medizin bestrebt, die Besonderheiten jedes einzelnen Patienten zu erfassen, um ihn bestmöglich und individuell behandeln zu können. Wo bisher in vielen Bereichen die ärztliche Erfahrung ein wesentliches Element für die Personalisierung der Medizin war, zeichnen sich jetzt neue quantitative Ansätze ab: In den zurückliegenden Jahren sind in der Grundlagenforschung völlig neue technische Methoden entwickelt worden, die eine umfassende molekulare Analytik jedes einzelnen Patienten zulassen. Bisher werden diese Methoden allerdings nur zu einem sehr kleinen Teil in der Routinediagnostik eingesetzt. Es ist aber erkennbar, dass der umfassende Einsatz dieser neuen Methoden es schon heute möglich machen würde, die Diagnostik auf eine völlig neue Ebene zu heben. Für die meisten Ansätze wird nur eine einfache Blutprobe benötigt, um mit Hilfe moderner Technologien eine detaillierte Momentaufnahme zu erstellen, die Aufschluss über molekulare Prozesse geben kann.
Neue Wege in der Omics-basierten Diagnostik
Neben der Untersuchung der Gesamtheit der Gene in einem Organismus – kurz: Genomik – hat auch die Analyse anderer Biomoleküle enorme Fortschritte gemacht und lässt sich durch automatisierte Abläufe im Hochdurchsatz-Verfahren anwenden. Die Transkriptomik liefert den Medizinern und Biowissenschaftlern Daten darüber, welche Gene gerade tatsächlich und wie stark abgelesen werden. Die Proteomik verrät, welche unterschiedlichen Protein-Moleküle als Bausteine und biologische Katalysatoren in den Zellen und Geweben vorkommen. Die Metabolomik erfasst die Gesamtheit aller Stoffwechselprodukte im Organismus und die Glycomic gibt Aufschluss über vorliegende Proteinmodifikationen durch Zuckeranteile.
Die genannten Techniken, aufgrund der gemeinsamen Endung oft unter dem Sammelbegriff „Omics“ zusammengefasst, machen im Zusammenspiel mit immer leistungsfähigeren Computersystemen inzwischen eine gewaltige Flut von Daten verfügbar. Die Herausforderung besteht jetzt darin, diese Daten so zu verarbeiten und miteinander zu verknüpfen, dass man aus ihnen möglichst präzise Vorhersagen ableiten kann. Gelingt dies, lassen sich individuelle Risiken und Empfänglichkeiten jedes einzelnen Menschen weitaus schneller und treffsicherer ermitteln, als man es noch vor wenigen Jahren für möglich gehalten hätte.
Präzise und evidenzbasierte Stratifizierung von Patienten
Dabei muss man noch nicht einmal verstehen, worin genau die Funktion jedes einzelnen Gens oder Eiweiß (Protein)-Moleküls liegt, um aus seinem Vorhandensein Schlüsse ziehen zu können. Für die praktische Medizin genügt es oft schon zu wissen, dass ein bestimmtes Diagnose-Ergebnis auf eine Erkrankung, ein besonderes Risiko oder eine andere wichtige Disposition hindeutet. Im Idealfall ist der Zusammenhang einfach: Wenn ein bestimmtes Molekül im Körper nachgewiesen werden kann, liegt die Krankheit X vor, beziehungsweise die Therapie Y ist anzuraten. Solche Moleküle – oder auch andere aussagekräftige Befunde, die man mittels einer Diagnose erfassen kann – bezeichnet man daher als Biomarker. Häufig ist jedoch die Erfassung mehrerer unterschiedlicher Biomarker erforderlich, um komplexe Krankheitsprozesse präzise vorhersagen zu können. Darüber hinaus fehlen für viele Krankheiten noch aussagekräftige Biomarker.
Mit Hilfe von Biomarkern, aber auch weiteren Parametern (beispielsweise Alter, Vorgeschichte und familiäre Anamnese, Lebensstil und weitere physiologische Voraussetzungen) lassen sich Patienten in Gruppen einteilen, für die jeweils bestimmte Therapie- oder Präventionsansätze sinnvoll sein können. Eine solche Einteilung nennen Fachleute Stratifizierung. Auch die Stratifizierung wird in der Medizin bereits seit langem praktiziert. Die Individualisierte Medizin erhebt darüber hinausgehend den Anspruch, diese Einteilung auf der Basis exakter, wissenschaftlich fundierter Kriterien vorzunehmen und strebt eine möglichst präzise Stratifizierung bis zur Einzelperson an. Es werden also evidenzbasierte und möglichst genaue Stratifizierungsverfahren gesucht, anstatt Einteilungen nur auf der Basis von deutlich unsichereren Erfahrungswerten vorzunehmen.
Die Zukunft der individualisierten Medizin hat bereits begonnen
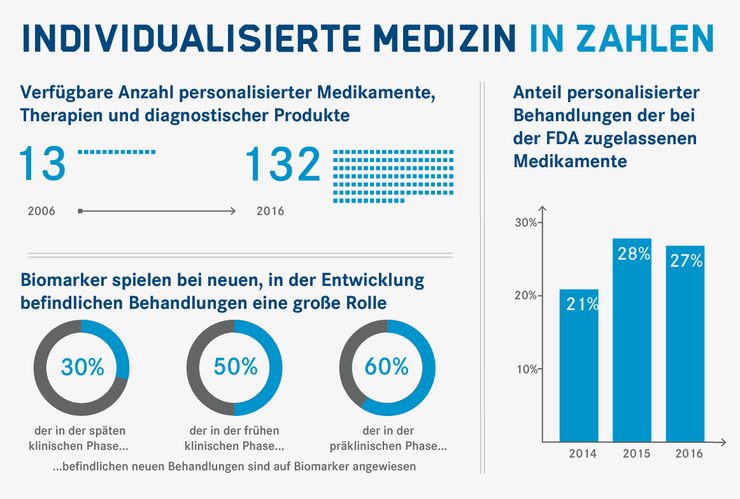
In einigen Bereichen hält der individualisierte Ansatz mittlerweile Einzug in die klinische Praxis und der Einsatz von Biomarkern für gezielte Behandlungen ist auf dem Vormarsch. Die Zahl der verfügbaren personalisierten Medikamente, Therapien und diagnostischer Produkte ist in den letzten Jahren um ein Vielfaches gestiegen und ein immer höherer Prozentsatz der in der Entwicklung befindlichen Behandlungen basiert auf Biomarkern.
Insbesondere die Krebsmedizin hat sich in den vergangenen Jahren stark in Richtung Individualisierung weiterentwickelt. Einer Tumorbehandlung geht heute in spezialisierten Zentren oft eine molekulargenetische Untersuchung der Krebszellen voraus, die eine detaillierte Stratifizierung von Krankheits-Subtypen erlaubt. Dabei bestimmt die Charakterisierung von Schlüsselmutationen und molekularer Signalwege die Diagnostik und spätere, auf die gefundenen Mutationen maßgeschneiderte therapeutische Intervention. So sind z.B. neue, gegen bestimmte Mutationen maßgeschneiderte Antikörper-basierte Therapien gegen Brust- und Darmkrebs erstaunlich erfolgreich. Aber auch in anderen Krankheitsfeldern, wie auch der Infektionsmedizin, finden sich zunehmend Therapien, die auf eine bestimme Patientengruppe zugeschnitten sind. Eines der wichtigsten Medikamente in der HIV/AIDS-Therapie beispielsweise führt bei manchen Patienten zu schweren, teilweise lebensbedrohlichen Nebenwirkungen. Verantwortlich dafür ist eine bestimmte genetische Veranlagung. Das Vorliegen dieser Veranlagung (und somit ein erhöhtes Risiko für entsprechende Nebenwirkungen) wird daher mittels genetischer Tests vor der Behandlung geprüft um bei Anwesenheit dieses Biomarkers eine alternative Therapie einzuleiten. In anderen Fällen sind es statt der Patienten die Krankheitserreger, die man in Gruppen unterteilt und mit unterschiedlichen Methoden bekämpft. Bei der Hepatitis C beispielsweise wird je nach dem vorliegenden genetischen Typ des Virus eine andere Behandlung ausgewählt. Diese ersten Beispiele einer molekularen und/oder evidenz-basierten Stratifizierung verdeutlichen die Bedeutung und das große Potential dieses Ansatzes und der angestrebten individualisierten Medizinfür alle Bereiche der Medizin, nicht zuletzt der Infektionsmedizin.
Jennifer Debarry, 2018
Kontakt
