Infektionsbiologie

Forschungsfokus
Trotz großer Fortschritte und wichtiger Ergebnisse in der Mikrobiomforschung in den letzten Jahren, steckt die Umsetzung dieser Erkenntnisse in neuartige Arzneimittel noch vielmals in der Anfangsphase, da es häufig unbekannt ist, welche Mitglieder des Mikrobioms und welche spezifischen Mechanismen für die gesundheitsfördernden und -schädigenden Auswirkungen verantwortlich sind. Daher haben wir in den letzten Jahren Methoden und Modelle entwickelt, die es uns ermöglichen, das komplexe Zusammenspiel zwischen Krankheitserregern, dem Mikrobiom und dem Wirt zu analysieren, um neue Erkenntnisse darüber zu gewinnen, wie die Manipulation mikrobieller Gemeinschaften therapeutisch genutzt werden kann. Wir haben uns insbesondere auf zwei Bereiche konzentriert: erstens auf die Rolle weit verbreiteter, aber noch nicht charakterisierter Mitglieder des Darmmikrobioms für das mikrobielle Ökosystem und zweitens auf die Nutzung des Potenzials von Bestandteilen des Mikrobioms), um den Ausschluss multiresistenter Enterobakterien wie Klebsiella pneumoniae und Escherichia coli aus dem Darm zu fördern. Durch die Kombination von Grundlagenforschung und translationaler Forschung wollen wir das Potenzial des Mikrobioms als Biomarker und therapeutisches Ziel voll ausschöpfen.
Forschungsfokus
Trotz großer Fortschritte und wichtiger Ergebnisse in der Mikrobiomforschung in den letzten Jahren, steckt die Umsetzung dieser Erkenntnisse in neuartige Arzneimittel noch vielmals in der Anfangsphase, da es häufig unbekannt ist, welche Mitglieder des Mikrobioms und welche spezifischen Mechanismen für die gesundheitsfördernden und -schädigenden Auswirkungen verantwortlich sind. Daher haben wir in den letzten Jahren Methoden und Modelle entwickelt, die es uns ermöglichen, das komplexe Zusammenspiel zwischen Krankheitserregern, dem Mikrobiom und dem Wirt zu analysieren, um neue Erkenntnisse darüber zu gewinnen, wie die Manipulation mikrobieller Gemeinschaften therapeutisch genutzt werden kann. Wir haben uns insbesondere auf zwei Bereiche konzentriert: erstens auf die Rolle weit verbreiteter, aber noch nicht charakterisierter Mitglieder des Darmmikrobioms für das mikrobielle Ökosystem und zweitens auf die Nutzung des Potenzials von Bestandteilen des Mikrobioms), um den Ausschluss multiresistenter Enterobakterien wie Klebsiella pneumoniae und Escherichia coli aus dem Darm zu fördern. Durch die Kombination von Grundlagenforschung und translationaler Forschung wollen wir das Potenzial des Mikrobioms als Biomarker und therapeutisches Ziel voll ausschöpfen.

Prof. Dr. Till Strowig
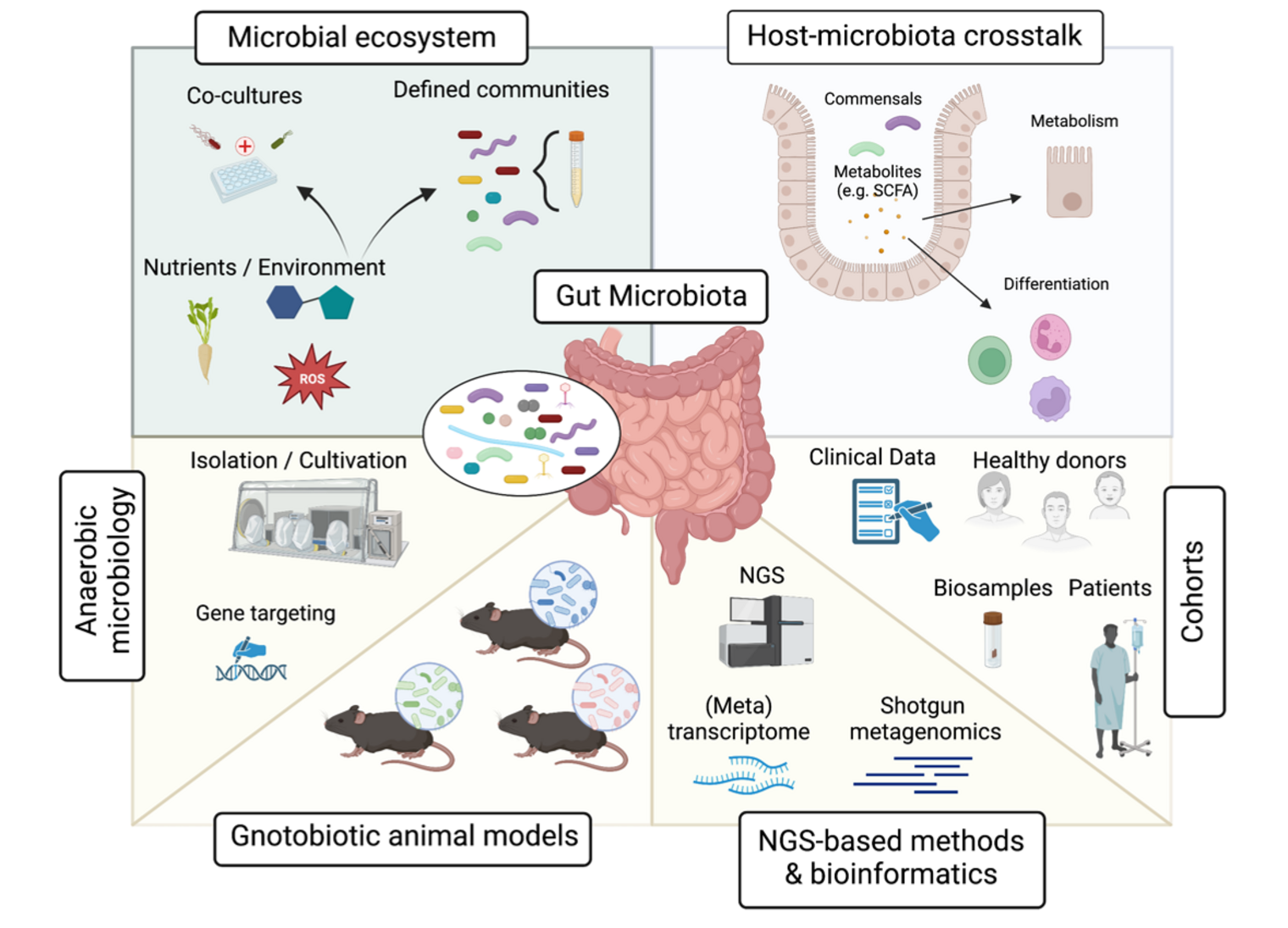
Menschen tragen verschiedenste mikrobielle Ökosysteme in sich, die unser tägliches Leben beeinflussen. Um verstehen zu können, wie wir mit diesen Ökosystemen interagieren, benötigen wir Modellsysteme, die experimentelle Veränderungen ermöglichen; sowohl am Wirt als auch an den Mikroben.

Till Strowig studierte Medizinische Biotechnologie an der Technischen Universität Berlin. Im Anschluss an seine Diplomarbeit an der „Rockefeller University“ in New York, USA, erhielt er ein Stipendium der Boehringer Ingelheim Stiftung, um dort auch die Arbeiten für seine Promotion durchzuführen.
Danach setzte er seine wissenschaftliche Ausbildung im Labor von Richard Flavell an der „Yale University“ fort – unterstützt von einem Stipendium der Leukemia and Lymphoma Society. Seit Juni 2013 leitet Till Strowig die Nachwuchsforschergruppe „Mikrobielle Immunregulation“ am HZI, die von Februar 2019 an zur gleichnamigen Abteilung gewachsen ist.
Forschungsprojekte
Interindividuelle Unterschiede in der (Darm-)Mikrobiota werden als Schlüsselfaktoren angesehen, die den klinischen Ausgang verschiedener infektiöser und immunvermittelter Krankheiten bestimmen. Anhand von keimfreien und gnotobiotischen Mausmodellen haben wir in den letzten zeigen können, dass die Mikrobiota die Anfälligkeit für bakterielle Infektionen beeinflußen kann und dass maßgeschneidertes Mikrobiom-Editing zur Verringerung der Anfälligkeit eingesetzt werden kann (Osbelt et al. 2021). Darüber hinaus konnten wir durch die Analyse der Mikrobiota in Kombination mit Metabolomik und der Isolierung von Kandidatenbakterien Bakterienarten identifizieren, die die Fähigkeit besitzen, mukosale und systemische Immunantworten zu modulieren (Zhao et al. 2023), sowie Kandidatenarten, die zu veränderten Verläufen immunvermittelter Krankheiten führen (Iljazovic et al. 2021). Derzeit laufende Projekte konzentrieren sich zum einen darauf zu untersuchen, welche genauen molekularen Mechanismen für die Interaktion zwischen Pathogenen und Mikrobiota verantwortlich sind, und zum anderen darauf wie gezielte Veränderung der Mikrobiota durch neuartige Antibiotika (Bullitz et al. 2023), Zugabe von probiotischen Bakterien oder Änderungen in der Diät (Siracusa et al. 2023) gesundheitsfördernd eingesetzt werden können.
Team
Bis zur Fertigstellung des Gebäudes ist die Gruppe im HZI untergebracht. Die aktuelle Teamliste finden Sie daher hier.
Publikationen
- Siracusa F, Schaltenberg N, Kumar Y, Lesker TR, Steglich B, Liwinski T, Cortesi F, Frommann L, Diercks BP, Bönisch F, Fischer AW, Scognamiglio P, Pauly MJ, Casar C, Cohen Y, Pelczar P, Agalioti T, Delfs F, Worthmann A, Wahib R, Jagemann B, Mittrücker HW, Kretz O, Guse AH, Izbicki JR, Lassen KG, Strowig T, Schweizer M, Villablanca EJ, Elinav E, Huber S, Heeren J, Gagliani N. Short-term dietary changes can result in mucosal and systemic immune depression. Nat Immunol. 2023 Sep;24(9):1473-1486. https://doi.org/10.1038/s41590-023-01587-x.
- Zhao B, Osbelt L, Lesker TR, Wende M, Galvez EJC, Hönicke L, Bublitz A, Greweling-Pils MC, Grassl GA, Neumann-Schaal M, Strowig T. Helicobacter spp. communities are prevalent in wild mice and protect from lethal Citrobacter rodentium infection in absence of adaptive immunity. Cell Reports 2023 May;42(6):112549. https://doi.org/10.1016/j.celrep.2023.112549 .
- Bublitz A, Brauer M, Wagner S, Hofer W, Musken M, Deschner F, Lesker TR, Neumann-Schaal M, Paul LS, Nubel U, Bartel J, Kany AM, Zuhlke D, Bernecker S, Jansen R, Sievers S, Riedel K, Herrmann J, Muller R, Fuchs TM*, Strowig T*. The natural product chlorotonil A preserves colonization resistance and prevents relapsing Clostridioides difficile infection. Cell Host Microbe 2023 Apr 18; https://doi.org/10.1016/j.chom.2023.04.003.
- P. Riese, S. Trittel, M. K. Akmatov, M. May, J. Prokein, T. Illig, C. Schindler, B. Sawitzki, Y. Elfaki, S. Floess, J. Huehn, A. J. Błażejewski, T. Strowig, E. A. Hernandez-Vargas, R. Geffers, B. Zhang, Y. Li, F. Pessler and C. A. Guzmán. Distinct immunological and molecular signatures underpinning influenza vaccine responsiveness in the elderly. Nat Commun. 2022 Nov 12;13 (1): 6894. https://doi.org/10.1038/s41467-022-34487-z.
- Osbelt L, Wende M, Almasi E, Derksen E, Muthukumarasamy U, Lesker TR, Galvez EJC, Pils MC, Schalk E, Chhatwal P, Farber J, Neumann-Schaal M, Fischer T, Schluter D, Strowig T. Klebsiella oxytoca causes colonization resistance against multidrug-resistant K. pneumoniae in the gut via cooperative carbohydrate competition. Cell Host Microbe 2021 Nov 10;29(11):1663-1679 e1667. https://doi.org/10.1016/j.chom.2021.09.003.
